 Sai cosa accomuna un subacqueo ad un astronauta? Perdere il contatto con ciò che è il nostro ambiente naturale di esseri che vivono immersi in un gas alla pressione di 1 atmosfera e che camminano con i piedi a terra.
Sai cosa accomuna un subacqueo ad un astronauta? Perdere il contatto con ciò che è il nostro ambiente naturale di esseri che vivono immersi in un gas alla pressione di 1 atmosfera e che camminano con i piedi a terra.
Siamo nati così e ormai non ci facciamo più caso ma….prendiamo la nostra muta subacquea e…
 Qual è il primo effetto di non essere più immersi nell’aria?
Quando ci immergiamo riceviamo una spinta dal basso verso l’alto uguale al peso del volume di liquido spostato dal nostro corpo, quanto maggiore è il volume tanto maggiore sarà la spinta verso l’alto. Questo principio (principio di Archimede) possiamo facilmente sperimentarlo quando ad esempio con delle inspirazioni profonde che aumentano il volume di aria nei nostri polmoni vogliamo spostarci verso l’alto, o quando, al contrario, facendo delle profonde espirazioni scendiamo verso il basso. Lo stesso principio è impiegato quando, ad esempio, “gonfiamo il GAV per sollevarci dal fondo”. Adesso ci circonda un liquido che esercita, su ogni cm quadrato del nostro corpo una pressione che è uguale sulla nostra testa come sulla pianta dei nostri piedi (legge di Pascal) e questa pressione aumenta man mano che aumenta la quantità di acqua sulla nostra testa. E’ stato misurarto che 10 metri di acqua sulla nostra testa esercitano la pressione di una atmosfera per cui a 10 metri di profondità sarò sottoposta a 1 atmosfera (pressione esercitata a livello del mare) + 1 atmosfera (pressione di una colonna di acqua di 10 metri) quindi 2 atmosfere, (Legge di Torricelli). A 10 metri di profondità il mio corpo deve adattarsi ad una pressione che è il doppio di quella a cui è abituato. Il nostro corpo è formato di strutture solide (gambe e braccia) il cui volume non varia e di cavità piene di aria (i polmoni) che sono deformabili (oltre che da cavità racchiuse da strutture ossee che sono indeformabili: seni mascellari etc.). Immaginiamo i nostri polmoni come due palloncini, all’aumentare della pressione diminuirà il loro volume (legge di Boyle) quindi a 2 atmosfere il volume si ridurrà della metà, a 3 atmosfere (-20 mt.) a 1/3. Cosa succede se respiro aria da una bombola al livello del mare? A 1 atmosfera respirerò 1 litro al minuto, a 10 metri di profondità respirerò 2 litri al minuto, a 20 metri 3 litri al minuto cioè all’aumentare della pressione il volume che occupa 1 litro di aria a 1 atm è uguale al volume che occupano 2 litri alla pressione di 2 atmosfere cioè a 10 metri di profondità. A 20 metri di profondità respirerò 3 litri al minuto per riempire i miei polmoni. Cosa succede se improvvisamente i tre litri di aria che sono nei miei polmoni vengono portati a livello del mare, a glottide serrata? Che avrei bisogno di polmoni 3 volte più grandi per contenere la stessa quantità di aria senza distruggerli per effetto della grande pressione.
Qual è il primo effetto di non essere più immersi nell’aria?
Quando ci immergiamo riceviamo una spinta dal basso verso l’alto uguale al peso del volume di liquido spostato dal nostro corpo, quanto maggiore è il volume tanto maggiore sarà la spinta verso l’alto. Questo principio (principio di Archimede) possiamo facilmente sperimentarlo quando ad esempio con delle inspirazioni profonde che aumentano il volume di aria nei nostri polmoni vogliamo spostarci verso l’alto, o quando, al contrario, facendo delle profonde espirazioni scendiamo verso il basso. Lo stesso principio è impiegato quando, ad esempio, “gonfiamo il GAV per sollevarci dal fondo”. Adesso ci circonda un liquido che esercita, su ogni cm quadrato del nostro corpo una pressione che è uguale sulla nostra testa come sulla pianta dei nostri piedi (legge di Pascal) e questa pressione aumenta man mano che aumenta la quantità di acqua sulla nostra testa. E’ stato misurarto che 10 metri di acqua sulla nostra testa esercitano la pressione di una atmosfera per cui a 10 metri di profondità sarò sottoposta a 1 atmosfera (pressione esercitata a livello del mare) + 1 atmosfera (pressione di una colonna di acqua di 10 metri) quindi 2 atmosfere, (Legge di Torricelli). A 10 metri di profondità il mio corpo deve adattarsi ad una pressione che è il doppio di quella a cui è abituato. Il nostro corpo è formato di strutture solide (gambe e braccia) il cui volume non varia e di cavità piene di aria (i polmoni) che sono deformabili (oltre che da cavità racchiuse da strutture ossee che sono indeformabili: seni mascellari etc.). Immaginiamo i nostri polmoni come due palloncini, all’aumentare della pressione diminuirà il loro volume (legge di Boyle) quindi a 2 atmosfere il volume si ridurrà della metà, a 3 atmosfere (-20 mt.) a 1/3. Cosa succede se respiro aria da una bombola al livello del mare? A 1 atmosfera respirerò 1 litro al minuto, a 10 metri di profondità respirerò 2 litri al minuto, a 20 metri 3 litri al minuto cioè all’aumentare della pressione il volume che occupa 1 litro di aria a 1 atm è uguale al volume che occupano 2 litri alla pressione di 2 atmosfere cioè a 10 metri di profondità. A 20 metri di profondità respirerò 3 litri al minuto per riempire i miei polmoni. Cosa succede se improvvisamente i tre litri di aria che sono nei miei polmoni vengono portati a livello del mare, a glottide serrata? Che avrei bisogno di polmoni 3 volte più grandi per contenere la stessa quantità di aria senza distruggerli per effetto della grande pressione.
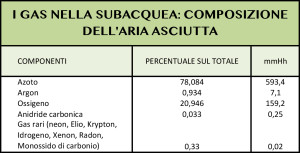 Nell’aria sono contenuti diversi gas per cui la pressione di 1 atmosfera è data dalla somma delle pressioni dei singoli gas che compongono l’aria (ossigeno, azoto, anidride carbonica) (Legge di Dalton) la pressione di ogni singolo componente si chiama pressione parziale ed è proporzionale alla percentuale con la quale quel gas è presente nella miscela: l’80% di 1 atmosfera di aria è data dall’azoto, il 20% dall’ossigeno. Oltre che essere presenti in forma di gas, queste sostanze sono in parte disciolte nel sangue dei capillari a contatto con gli alveoli polmonari e la quantità di gas che passa dall’aria al sangue dipende dalla pressione parziale di ogni singolo componente, per cui il gas che si discioglie in maggiore quantità è l’azoto che esercita l’80% della pressione, seguito dall’ossigeno che esercita solo il 20 % della pressione totale (legge di Henry). Se ritorno alla profondità di -20 metri respirerò aria alla pressione di 3 atmosfere, delle quali il 20% = 600 millibar (1 atmosfera=1 bar=760 mmHg) saranno di ossigeno. Tanto più profonda è l’immersione, tanto maggiore sarà la quantità di gas che passa in soluzione nel sangue. Risalendo in superficie ho il fenomeno opposto e le molecole disciolte nel sangue ritornano a volatilizzarsi in aria. Se la risalita in superficie è troppo veloce, questi gas lasciano il sangue e i tessuti in cui si sono disciolti, in maniera tumultuosa, formando bolle e predisponendo alla ben nota malattia da decompressione. Ultimo esempio: la Legge di Charles. Ti sei chiesto perché le bombole si caricano di solito immerse nell’acqua? Quanto più carichiamo le bombole, tanto più aumentiamo la pressione al loro interno, l’aumento di pressione crea, nel gas che stiamo comprimendo, un aumento di temperatura. Quando le bombole si raffreddano di conseguenza diminuisce la pressione. Per ovviare a questo inconveniente, raffreddando le bombole che sto caricando, faccio in modo da evitare cali di pressione dopo che ho caricato la mia bombola, così che i 200 bar con cui l’ho caricata siano gli stessi con cui mi immergo.
Nell’aria sono contenuti diversi gas per cui la pressione di 1 atmosfera è data dalla somma delle pressioni dei singoli gas che compongono l’aria (ossigeno, azoto, anidride carbonica) (Legge di Dalton) la pressione di ogni singolo componente si chiama pressione parziale ed è proporzionale alla percentuale con la quale quel gas è presente nella miscela: l’80% di 1 atmosfera di aria è data dall’azoto, il 20% dall’ossigeno. Oltre che essere presenti in forma di gas, queste sostanze sono in parte disciolte nel sangue dei capillari a contatto con gli alveoli polmonari e la quantità di gas che passa dall’aria al sangue dipende dalla pressione parziale di ogni singolo componente, per cui il gas che si discioglie in maggiore quantità è l’azoto che esercita l’80% della pressione, seguito dall’ossigeno che esercita solo il 20 % della pressione totale (legge di Henry). Se ritorno alla profondità di -20 metri respirerò aria alla pressione di 3 atmosfere, delle quali il 20% = 600 millibar (1 atmosfera=1 bar=760 mmHg) saranno di ossigeno. Tanto più profonda è l’immersione, tanto maggiore sarà la quantità di gas che passa in soluzione nel sangue. Risalendo in superficie ho il fenomeno opposto e le molecole disciolte nel sangue ritornano a volatilizzarsi in aria. Se la risalita in superficie è troppo veloce, questi gas lasciano il sangue e i tessuti in cui si sono disciolti, in maniera tumultuosa, formando bolle e predisponendo alla ben nota malattia da decompressione. Ultimo esempio: la Legge di Charles. Ti sei chiesto perché le bombole si caricano di solito immerse nell’acqua? Quanto più carichiamo le bombole, tanto più aumentiamo la pressione al loro interno, l’aumento di pressione crea, nel gas che stiamo comprimendo, un aumento di temperatura. Quando le bombole si raffreddano di conseguenza diminuisce la pressione. Per ovviare a questo inconveniente, raffreddando le bombole che sto caricando, faccio in modo da evitare cali di pressione dopo che ho caricato la mia bombola, così che i 200 bar con cui l’ho caricata siano gli stessi con cui mi immergo.
da www.fondali.it – di Francesco Mazzei



