TEMPERATURA COSTANTE
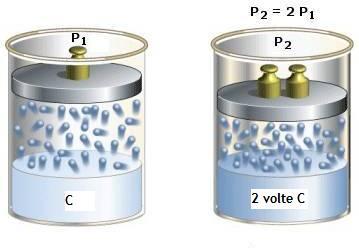
“A temperatura costante, il quantitativo di gas che si può disciogliere in un liquido è proporzionale alla pressione che quel gas esercita sulla superficie del liquido.”
Questa legge si applica sia ai gas puri che alle miscele di gas; ciascun gas contenuto in una miscela si comporta indipendentemente dagli altri gas presenti e si scioglie nel liquido in proporzione alla sua pressione parziale (Pp). La velocità con cui viene raggiunto l’equilibrio varia a seconda della composizione del liquido, delle caratteristiche di solubilità del gas, dell’ampiezza della superficie di contatto fra il liquido e il gas, della temperatura e di altri parametri meno rilevanti.
SATURAZIONE:
quando la pressione del gas sciolto nel liquido eguaglia la pressione del gas nel miscuglio a contatto col liquido, si instaura un equilibrio fra il numero di molecole di gas che si sciolgono e il numero di quelle che vengono liberate dal liquido. Il liquido si definisce in STATO DI SATURAZIONE per quel gas a quella pressione ambiente.
SOVRASATURAZIONE: se la pressione parziale del gas sciolto nel liquido è superiore a quella del gas nel miscuglio, il liquido si definisce SOVRASATURO e le molecole tenderanno a passare in maggior numero dal liquido alla fase gassosa, fino a raggiungere lo stato di equilibrio. Il fenomeno inverso si verifica se la pressione parziale del gas nel miscuglio è superiore a quella del liquido.
LEGGE DI HENRY
Quest’enunciato è d’importanza fondamentale per capire cosa accade all’organismo in termine di saturazione e desaturazione dei gas quando si scende in profondità equipaggiati con ARA e, soprattutto, ai fini della sicurezza e dell’insorgere d’eventuali embolie gassose, quando si risale in superficie.
Bisogna ricordare che l’aria atmosferica che si respira è composta da una miscela di gas, due dei quali partecipano agli scambi alveolari (ossigeno ed anidride carbonica) mentre gli altri, fra cui l’azoto (che costituisce circa il 78% di tutta la miscela), sono definiti inerti perché sono assunti ed espirati senza subire trasformazioni all’interno del nostro organismo.
Soltanto i gas inerti (e quindi soprattutto l’azoto) interessano ai fini dell’applicazione pratica della legge di Henry.
Nella nostra vita aerea, siamo saturi d’azoto per circa 1 atmosfera, e possiamo considerare poco indicative le eventuali variazioni di pressione, che invece diventano imponenti nel momento in cui scendiamo in acqua (ogni 10 metri di colonna di liquido aggiunge 1 atmosfera a quella che grava sulla superficie del mare).
Durante la discesa, l’azoto che viene inspirato aumenta la sua pressione parziale in modo proporzionale a quella esterna e, come dice l’enunciato di Henry, si trasferisce dai polmoni al sangue in forma liquida. Questa fase si chiama di “saturazione” e termina nel momento in cui, raggiunta una determinata quota per un periodo sufficientemente lungo, la pressione dei gas inerti all’interno del corpo è pari a quella esterna (equilibrio pressorio).
Durante la risalita avviene il fenomeno inverso e l’azoto in eccesso torna allo stato liquido, attraversa il sistema venoso e viene eliminato attraverso la respirazione, in modo asintomatico, a condizione che vengano rispettati i giusti tempi di ascesa e delle eventuali soste di decompressione.
L’esempio della bottiglia di spumante è molto calzante ed è adottato dalle didattiche di tutto il mondo: all’interno della bottiglia di spumante vi è disciolto del gas a pressione (CO2 in questo caso); nel momento in cui il tappo della bottiglia viene tolto, l’anidride carbonica ritorna al suo stato gassoso e perciò tende a fuoriuscire con violenza dal suo contenitore. Se quest’operazione è fatta con estrema cautela, si può evitare la fuoriuscita dello spumante, proprio come nell’organismo si può evitare la violenta fuoriuscita dell’azoto. Attenzione però: le disattenzioni e le imprudenze si possono pagare con l’embolia gassosa!
Una volta usciti dall’acqua la desaturazione non sarà ancora terminata, per questo motivo una seconda immersione dovrà essere affrontata utilizzando delle particolari tabelle che tengono conto dell’azoto residuo per calcolare il massimo tempo di permanenza possibile a determinate profondità.


